Programma E.R.A.S. (Enhanced Recovery After Surgery)

Che cos’è?
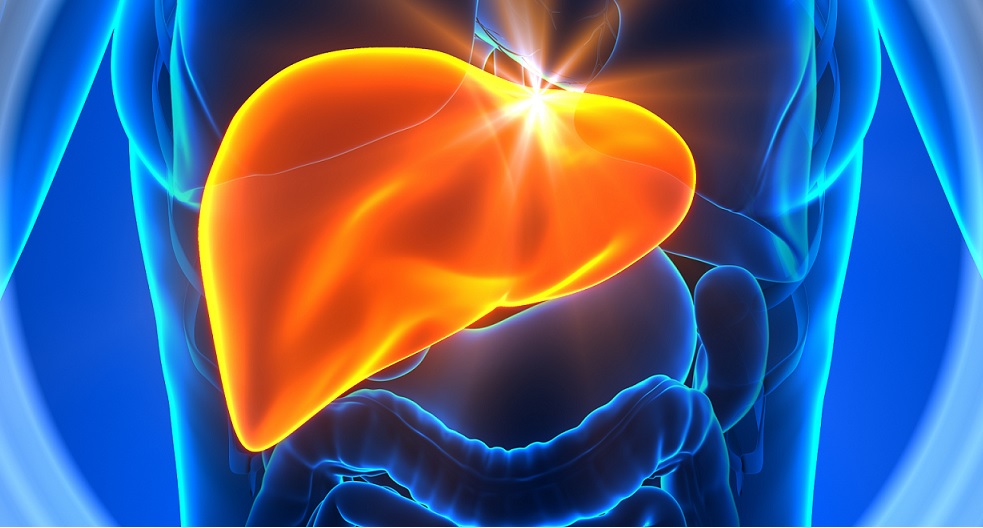
Il fegato è un organo parenchimatoso situato nel quadrante addominale superiore destro.
Il tumore del fegato è una patologia dovuta alla moltiplicazione incontrollata di cellule all’interno del fegato, che si trasformano in maligne. Esistono due tipologie di tumore del fegato: il tumore primitivo, che origina direttamente dal fegato e il tumore secondario o metastatico, che deriva da tumori che nascono in altri organi (ad esempio colon, stomaco, pancreas) e interessano successivamente il fegato.
Esistono due fattori molto importanti che favoriscono l’insorgenza di un tumore del fegato, che sono le epatiti croniche (in particolare da virus B) e la cirrosi epatica.
Evoluzione
Una volta che si è accertata la presenza di un tumore del fegato, il medico effettua la stadiazione, cioè la definizione del grado di malignità e di espansione del tumore finalizzata alla programmazione della cura. Il metodo più usato per questa stadiazione è il sistema TNM che prende in considerazione le dimensioni del tumore (T), l’eventuale interessamento dei linfonodi (N) e l’eventuale presenza di metastasi in altri organi (M). Nel caso del tumore del fegato, questa fase è particolarmente importante per decidere se è possibile o meno procedere per via chirurgica. Il tumore del fegato è molto grave a causa del ruolo fondamentale dell’organo e dei suoi rapporti con gli altri organi addominali.
Sintomi
L’esordio dei sintomi del tumore del fegato è insidioso, motivo per cui spesso il tumore è già in fase avanzata quando il paziente giunge dal medico. I sintomi comunque più comuni sono: dolore addominale, perdita di peso, stanchezza, anoressia.
Come si fa la diagnosi
La diagnosi è sia clinica, quindi con visita e valutazione da parte del medico della storia del paziente, che strumentale. I principali esami diagnostici utilizzati per il tumore del fegato sono: l’ecografia addominale, la TC, che permette di valutare anche gli altri organi addominali; la Risonanza Magnetica, che permette di ottenere immagini molto accurate in questi casi; la Colangiopancreatografia Retrograda Endoscopica (ERCP) e l’ecoendoscopia, esami endoscopici, radiologico il primo ed ecografico il secondo, che consentono di visualizzare le vie biliari all’interno ed all’esterno del fegato, eseguiti principalmente nei casi di tumori che interessano i dotti biliari; la Biopsia epatica, che consiste in una puntura ecoguidata del fegato al fine di ottenerne un campione di cellule da far analizzare all’anatomopatologo.
Come si cura
Il trattamento che fornisce maggiori riscontri è quello chirurgico. Tra le terapie non chirurgiche abbiamo: -la Chemioterapia sistemica, che include trattamenti sia per ridurre e controllare la malattia al fegato prima di un intervento chirurgico sia per limitare le recidive dopo l’intervento. Attraverso l’utilizzo dei nuovi farmaci biologici è anche possibile personalizzare la terapia per ottimizzarne i risultati; -la chemioembolizzazione e l’embolizzazione arteriosa del fegato consentono terapie locoregionali in pazienti non suscettibili di altri trattamenti. Con queste metodiche è anche possibile somministrare alcuni farmaci al fine di ottenere un controllo locale della malattia; -le terapie ablative percutanee, tra cui la radiofrequenza, consistono in una puntura ecoguidata del tumore del fegato con aghi dedicati, poi collegati a fonti di energia che distruggono le cellule tumorali; -la radioterapia e radiochirurgia permette di irradiare la parte malata del fegato con sofisticati acceleratori lineari che distruggono il tumore preservando però i tessuti sani circostanti.
In che cosa consiste l’intervento chirurgico
La chirurgia del fegato viene eseguita con metodica ecoguidata: attraverso l’utilizzo dell’ecografia in sala operatoria, il chirurgo è in grado di identificare con precisione la sede della malattia all’interno del fegato e può dunque eseguire interventi radicali ma conservativi, risparmiando il più possibile il tessuto epatico (parenchima) sano. Esso può consistere in una resezione di un lobo, di uno o più segmenti epatici, o nella resezione di una sola porzione contenente il tumore.
Come può essere eseguito l’intervento chirurgico
L’intervento chirurgico può essere eseguito con metodica tradizionale “open”, con un taglio sottocostale, oppure con un approccio “mini-invasivo” che permette di eseguire le medesime manovre chirurgiche attraverso piccole cannule introdotte nell’addome, evitando così grandi incisioni.
Quali sono i vantaggi della chirurgia robotica per questo tipo di intervento
La chirurgia robotica nel tumore del fegato offre numerosi vantaggi soprattutto perché permette un accesso e quindi un intervento sui lobi posteriori del fegato che sono più difficilmente accessibili con la metodica tradizionale o laparoscopica.
Inoltre:
>Riduce al minimo la manipolazione della lesione riducendo la possibilità di diffusione di cellule maligne.
>Riduce in modo significativo le perdite di sangue non la conseguente riduzione della necessità di eseguire emo-trasfusioni.
>Offre la possibilità in alcuni casi di operare anche tumori di dimensioni maggiori ed in pazienti obesi che difficilmente potrebbero essere operati in laparoscopia e che quindi necessiterebbero di una conversione in intervento tradizionale. Ci sono evidenze che i tassi di conversione degli interventi in chirurgia robotica sono sensibilmente inferiori a quelli in chirurgia laparoscopica.
>Riduce al minimo la manipolazione dei visceri favorendo una più rapida ripresa della loro motilità nel post-operatorio
>Offre la possibilità al paziente, laddove necessario, di iniziare prima il trattamento di Chemioterapia post-operatoria.
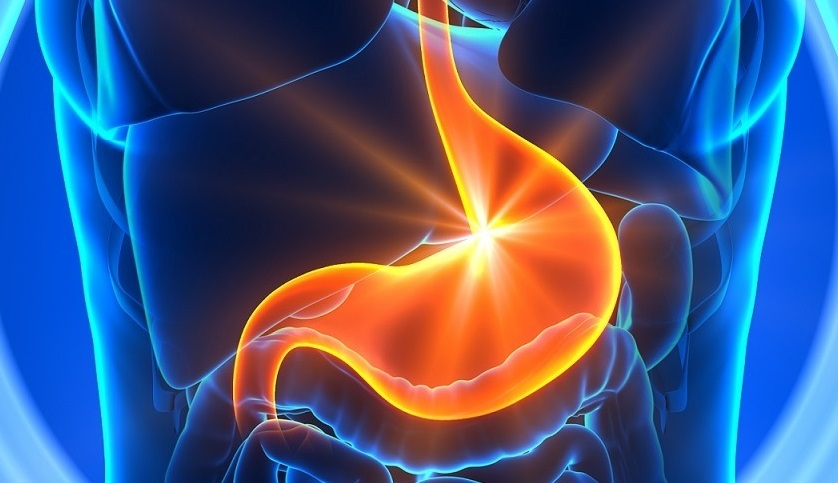
TUMORE DELLO STOMACO
Che cos’è
Lo stomaco è un organo cavo che fa parte dell’apparato gastrointestinale. È anatomicamente suddiviso in cinque porzioni: il cardias, il fondo, il corpo, l’antro e il piloro.
I tumori dello stomaco originano principalmente dalla mucosa (la parte più interna della parete gastrica) e vengono definiti adenocarcinomi; meno frequentemente nascono dagli strati più profondi della parete (GIST, sarcomi), dal tessuto linfatico (linfomi) e, più raramente, da cellule che producono ormoni (carcinoidi).
Evoluzione
L’evoluzione della malattia dipende principalmente dal grado di coinvolgimento della parete dello stomaco, che può essere di pochi millimetri, con una prognosi migliore, fino al completo interessamento dell’organo. Inoltre, l’adenocarcinoma, crescendo, può coinvolgere i linfonodi adiacenti lo stomaco fino ad invadere gli organi vicini o metastatizzarsi, attraverso il sangue, in organi distanti (come polmone o fegato) o diffondersi al peritoneo, cosa che comporta l’inoperabilità della malattia.
Sintomi
I sintomi del tumore dello stomaco sono spesso vaghi e aspecifici e non di rado addirittura assenti per un lungo periodo di tempo, tanto da consentire la diagnosi solo quando la neoplasia è ormai in uno stadio estremamente avanzato.
Sono in genere più evidenti nelle sedi dove lo stomaco è più stretto, come all’ingresso (cardias) o alla fine (piloro). Nelle forme iniziali sono principalmente rappresentati da difficoltà di digestione, eruttazioni postprandiali, senso di riempimento precoce.
Nausea, vomito, dolore epigastrico, dimagramento e stanchezza sono in genere segni di neoplasia più avanzata.
Come si fa la diagnosi
L’esame diagnostico più importante è l’EGDS (esofago-gastro-duodeno-scopia) che permette sia la visione diretta della lesione tumorale che il prelievo di piccolo quantità di tessuto (biopsie) da far esaminare con esame istologico.
Anche l’indagine radiologica, in particolare con il metodo del doppio contrasto, ha un alto indice diagnostico, pur con i limiti di un’impossibile definizione istologica.
Prima di essere sottoposti ad intervento chirurgico è sempre indicato eseguire un esame dell’addome con ecografia e una TAC con mezzo di contrasto, per valutare l’eventuale estensione locale della malattia e l’eventuale presenza di metastasi in altri organi.
Come si cura
Le possibilità terapeutiche del tumore dello stomaco sono essenzialmente chirurgiche, essendo la radioterapia e la chemioterapia scarsamente efficaci. La terapia chirurgica può essere effettuata con intenti radicali curativi o palliativi.
La chemioterapia e la radioterapia si integrano comunque con la chirurgia e possono essere effettuate sia prima (CHT Neoadiuvante, con lo scopo di ridurre le dimensioni del tumore per facilitarne la resecabilità chirurgica) che dopo (CHT-RT Adiuvante) l’intervento chirurgico.
Nelle forme più iniziali, dove la neoplasia si limita agli strati più interni della parete gastrica (mucosa ed iniziale strato della sottomucosa) e non sono riconoscibili linfonodi malati, l’asportazione endoscopica della lesione è sicura e curativa.
In che cosa consiste l’intervento chirurgico
L’intervento chirurgico consiste nella rimozione di 2/3 dello stomaco (gastrectomia subtotale) o di tutto l’organo (gastrectomia totale). L’entità della rimozione chirurgica dipende dalla sede della malattia: se questa è situata nelle porzioni finali dello stomaco, non è necessario rimuoverlo tutto, mentre se la lesione si trova nelle porzioni più superiori, la rimozione completa è una scelta obbligata. La continuità intestinale viene ripristinata collegando tra di loro i monconi di stomaco (in caso di gastrectomia subtotale) o di esofago (in caso di gastrectomia totale) con l’intestino tenue.
Parte integrante del trattamento chirurgico è l’asportazione dei linfonodi regionali, che in percentuale assai elevata possono essere sede di malattia.
Come può essere eseguito l’intervento chirurgico
L’intervento può essere eseguito con una metodica tradizionale “open” con un taglio mediano o sottocostale oppure con un approccio “mini-invasivo” che permette di eseguire le medesime manovre chirurgiche attraverso piccole cannule introdotte nell’addome, evitando così grandi incisioni. Questo approccio permette di ottenere nei pazienti idonei gli stessi risultati oncologici dell’approccio tradizionale a fronte di un recupero più rapido e complicanze ridotte.
Quali sono i vantaggi della chirurgia robotica per questo tipo di intervento
La chirurgia robotica del tumore dello stomaco offre particolari vantaggi soprattutto perché grazie alla sua definizione ed all’accuratezza permette di effettuare una linfadenectomia (asportazione dei linfonodi adiacenti allo stomaco) più valida, con minor rischio di recidive locali di malattia.
Inoltre:
>Riduce al minimo la manipolazione della lesione riducendo la possibilità di diffusione di cellule maligne.
>Riduce in modo significativo le perdite di sangue non la conseguente riduzione della necessità di eseguire emo-trasfusioni.
>Offre la possibilità in alcuni casi di operare anche tumori di dimensioni maggiori ed in pazienti obesi che difficilmente potrebbero essere operati in laparoscopia e che quindi necessiterebbero di una conversion in intervento tradizionale. Ci sono evidenze che i tassi di conversion degli interventi in chirurgia robotica sono sensibilmente inferiori a quelli in chirurgia laparoscopica.
>Riduce al minimo la manipolazione dei visceri favorendo una più rapida ripresa della loro motilità nel post-operatorio
>Offre la possibilità al paziente, laddove necessario, di iniziare prima il trattamento di Chemioterapia post-operatoria.
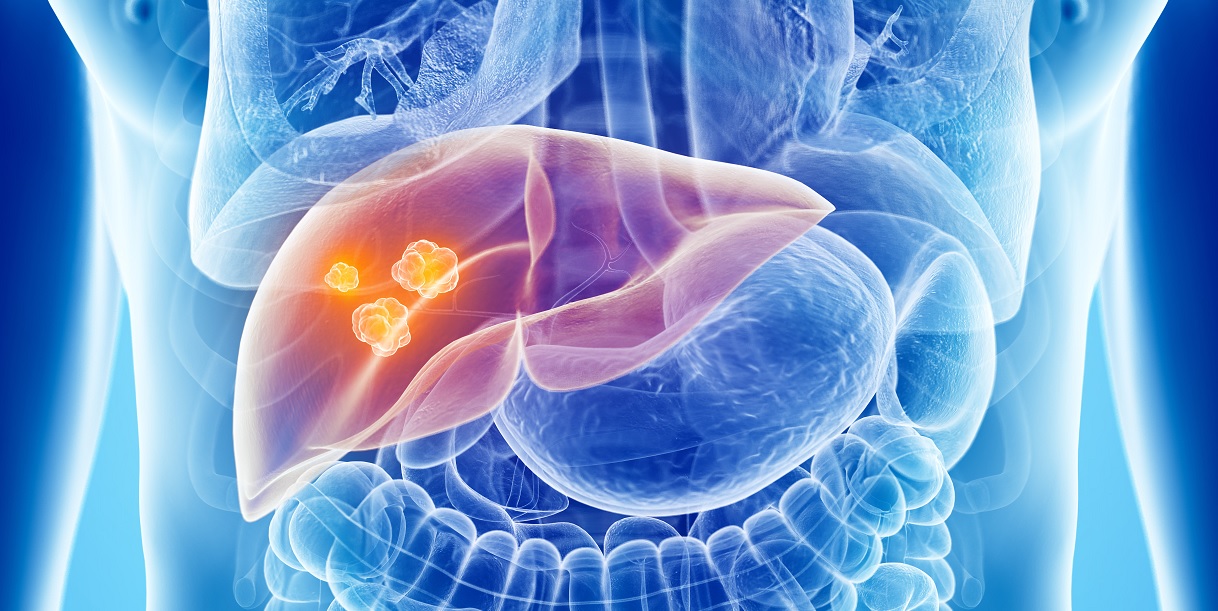
CALCOLOSI DELLA COLECISTI E DELLE VIE BILIARI
Che cos’è?
La calcolosi della colecisti è una patologia caratterizzata dalla formazione di calcoli, simili a piccoli sassi duri formati da sali e colesterolo, che si sviluppano nella colecisti (o cistifellea). La colecisti è un organo situato nella parte superiore destra dell’addome, al di sotto del fegato, che ha la funzione di raccogliere la bile prodotta dal fegato e riversarla nell’intestino. Quando i calcoli sono presenti all’interno della via biliare principale(ovvero i dotti che dal fegato si dirigono verso l’intestino) si parla di calcolosi coledocica.
Sintomi
Spesso i pazienti affetti da calcolosi della colecisti non presentano nessuna sintomatologia.
Il sintomo più comune è la colica biliare, un dolore localizzato nella parte superiore destra dell’addome della durata di almeno mezz’ora, talvolta associato a nausea e vomito, abbastanza intenso da costringere il paziente a interrompere ogni attività. In altri casi i calcoli della colecisti possono causare sintomi o complicanze anche severe, come la colecistite acuta, l’empiema della colecisti o la pancreatite acuta.
I calcoli della via biliare possono determinare invece ittero, ovvero una colorazione giallastra inizialmente degli occhi e quindi della cute, febbre e dolore addominale.
Come si fa la diagnosi
Una semplice ecografia addominale consente di riscontrare i calcoli di varie dimensioni all’interno della colecisti.
Metodi che più sofisticate come la TC o la Colangiografia con Risonanza Magnetica sono generalmente riservate per lo studio delle complicanze della calcolosi della colecisti, in particolare per la calcolosi estesa alle vie biliari.
Come si cura
La rimozione chirurgica della colecisti stessa è l’unica terapia risolutiva per la calcolosi della colecisti, in quanto la dissoluzione dei calcoli ottenibile con i farmaci o la semplice rimozione dei calcoli non evita il loro riformarsi. Quando sono presenti calcoli anche all’interno delle vie biliari il solo intervento di colecistectomia laparoscopica non è sufficiente per risolvere la malattia. E’ necessario infatti rimuovere i calcoli all’interno delle vie biliari tramite una procedura endoscopica detta ERCP (colangiopancreatografia retrograda endoscopica), che può essere eseguita prima o durante la colecistectomia stessa.
In che cosa consiste l’intervento chirurgico
L’intervento di asportazione chirurgica della colecisti viene eseguito nella grande maggioranza dei casi per via laparoscopica, tramite tre o quattro piccole incisioni dell’addome oppure tramite laparotomia (il taglio tradizionale) in casi particolari. La tecnica laparoscopica consente infatti un recupero più veloce e cicatrici meno visibili.
ERNIE DELLA PARETE ADDOMINALE
Che cos’è?
L’ernia della parete addominale consiste nella fuoriuscita di un viscere o di una sua porzione attraverso un’area di debolezza della parete addominale o attraverso un orifizio naturale.
Ogni ernia è infatti costituita da:
> una porta erniaria attraverso la quale si fa strada e che la contraddistingue, dandole il nome: ernia inguinale, crurale, ombelicale.
> un sacco costituito dal peritoneo parietale estroflesso e nel quale sono distinguibili un colletto (orifizio del sacco)
> un contenuto rappresentato dal viscere all’interno del sacco o da una porzione di esso.
Le ernie addominali sono un problema molto frequente, interessando circa il 5% della popolazione. A seconda del tipo di porta erniaria è quindi possibile differenziare il tipo di ernia, fra le più comuni troviamo l’ernia inguinale, l’ernia crurale, l’ernia ombelicale e l’ernia epigastrica.
Esistono altri tipi di ernia, più rari, che si fanno strada tra i muscoli della parete addominale anteriore (ernia di Spigelio) o posteriore (ernie lombari) o attraverso il forame otturatorio del
bacino (ernia otturatoria). Quando un’ernia si sviluppa attraverso un difetto della parete addominale determinato da una
pregressa incisione chirurgica si parla di laparocele ovvero un’ernia post-incisionale. Il laparocele rappresenta una frequente complicanza postoperatoria.
Sintomi
L’ernia addominale può essere del tutto asintomatica, cioè essere visibile senza tuttavia dare alcun disturbo, fuoriuscendo solo in seguito a sforzi che aumentano la pressione all’interno dell’addome (tosse, starnuti, defecazione).
Generalmente il paziente avverte fastidio o dolore nella sede dell’ernia. Il fastidio e il dolore possono aumentare in caso di lunghe camminate, esercizio fisico, stando in posizione eretta prolungata oppure in caso di sforzi addominali intensi. Nel caso di comparsa di dolore violento nella sede dell’ernia molto probabilmente ci troviamo di fronte ad un’ernia addominale complicata, ad esempio strozzata, da trattare con un intervento chirurgico d’urgenza.
Come si fa la diagnosi
Per la diagnosi è sufficiente una visita medica e l’osservazione della tipica tumefazione. La diagnostica strumentale spesso non è necessaria e viene riservata unicamente nei casi in cui l’esame clinico non è dirimente. In caso di un’ernia post-incisionale è invece indicato eseguire una TC addome, al fine di indagare in modo più approfondito la reale estensione del difetto di parete.
Come si cura
La terapia per l’ernia della parete addominale è unicamente chirurgica.
In che cosa consiste l’intervento chirurgico
L’intervento chirurgico consiste nella riduzione del viscere erniato in addome e nel rinforzare la parete addominale tramite applicazione di una “rete” di contenimento che riduce la possibilità in
futuro di nuovo cedimento della parete.
Come può essere eseguito l’intervento chirurgico
L’intervento può essere eseguito per via tradizionale (laparotomica, quindi con il taglio classico) oppure per via laparoscopica.
A seconda della sede e della dimensione dell’ernia l’intervento potrà essere eseguito in anestesia locale, in anestesia spinale o in anestesia generale.
L’intervento eseguito tramite laparoscopia prevede invece tre piccole incisioni all’altezza dell’ombelico e l’anestesia generale.
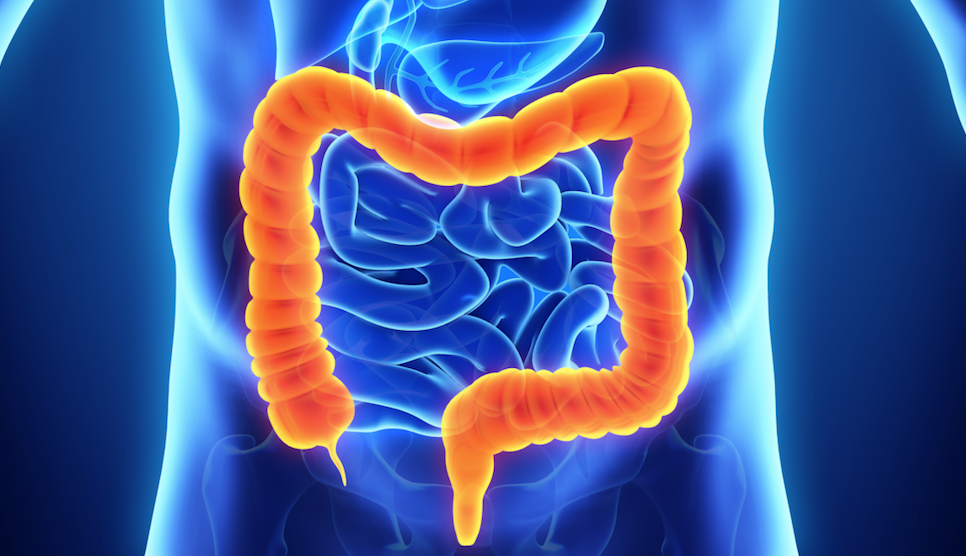
Tumore del Colon-Retto
Che cos’è?
Il tumore del colon-retto è quella forma di neoplasia che origina dalle cellule che rivestono l’ultimo tratto del tubo digerente chiamato intestino crasso e formato appunto dal colon ascendente con l’appendice, dal colon trasverso, dal colon discendente, dal sigma e dal retto. La maggior parte dei tumori del colon hanno origine dalla trasformazione maligna dei polipi e questo rischio è tanto più alto quanto maggiore è la dimensione di essi. Non tutti i polipi però hanno un evoluzione maligna, in alcuni casi come i polipi iperplastici essi hanno solo tendenza a crescere in dimensione senza assumere carettere di malignità.
Evoluzione
L’evoluzione della malattia, come in altri casi di neoplasie, dipende da più fattori. Esistono diversi tipi di classificazione per i tumori del colon ma quello più comunemente usato è il sistema TNM che prende in considerazione le dimensioni del tumore (T), l’eventuale interessamento dei linfonodi (N) e l’eventuale presenza di metastasi in altri organi (M).
E’ utile il dosaggio di un marcatore tumorale chiamato CEA che più che una sensibiltà diagnostica o di screening ha un elevato valore nel valutare la gravità della malattia e la sua evoluzione, in quanto assume valori altissimi quando il tumore è esteso e si reduce per esempio quando il tumore risponde ad un eventuale trattamento chemio e/o radio-terapico.
Sintomi
Uno dei sintomi più sospetto di cancro del colon è la presenza di sangue nelle feci; ma non sempre i polipi del colon danno sanguinamento manifestandosi, questo, solo in circa il 5% dei casi. Inoltre la presenza o assenza di questo dato dipende anche dalla sede della lesione, I tumori colpiscono quasi nella metà dei casi il sigma o il retto, in un quarto dei casi il colon ascendente e nella restante percentuale il trasverso o il colon discendente.
Tranne casi conclamati in cui la lesione causa una vera e propria emorragia oppure le sue dimensioni ostriscono completamente il lume dell’intestino, i sintomi possono essere vaghi come stanchezza, perdita di peso, mancanza di appetito e comparsa di anemia; un altro sintomo che può mettere in allarme il paziente è l’insorgenza di un irregolarità intestinale non presente prima con stipsi alternate a diarrea.
Come si fa la diagnosi
Per fortuna grazie alle campagne di prevenzione e di screening nelle popolazioni a rischio, la diagnosi viene fatta sempre più precocemente.
L’esame diagnostica di scelta è la colonscopia che permette sia la visione diretta della massa tumorale che il prelievo di piccolo quantità di tessuto (biopsie) da far esaminare con esame istologico.
In caso di Cancro del retto in circa il 70% dei casi è possibili fare diagnosi con l’esame clinico mediante esplorazione rettale.
Prima di essere sottoposti ad intervento chirurgico è sempre indicato eseguire una TAC con mezzo di contrasto, cosidetta di stadiazione, per valutare la eventuale estensione locale della malattia e l’eventuale presenza di metastasi in altri organi.
Altri esami utili per effettuare una corretta stadiazione dono l’ecografia del fegato, primo organo ad essere interessato da eventuali metastasi e l’RX del torace.
In caso di tumori del retto, ulteriori esami utili prima di eseguire l’intervento chirurgico, sono l’ecoendoscopia transrettale e la Risonanza Magnetica con bobina rettale che servono a valutare quanto sia interessata dal tumore la parete dell’organo.
Come si cura
La terapia di prima scelta, quando è possibile, è l’intervento chirurgico che consiste nell’asportazione del segmento di colon a seconda di dove è localizzata la lesione (ascendente, trasverso, discendente, sigma e retto) o più segmenti insieme, unitamente all’asportazione dei linfonodi situati nelle sedi che per primi vengono raggiunti da cellule maligne metastatiche.
In caso di fase molto precoce di malattia e o di polipi non completamente trasformati in maligni, è possibile effettuare un escissione locale della lesione in corso di colonscopia o per via trans-anale a seconda della sede.
La chemioterapia e la radioterapia si integrano con la chirurgia e possono essere effettuate sia prima (CHT-RT Neoadiuvante nei tumori del retto) che dopo (CHT Adiuvante nei tumori del colon) l’intervento chirurgico.
Le possibilità di cura del cancro del colon-retto e la sua prognosi dipendono dallo stadio del tumore unite alle condizioni generali del paziente.
In che cosa consiste l’intervento chirurgico
L’intervento chirurgico consiste nell’asportazione di uno più segmenti di colon a seconda della sede della malattia unitamente ai linfonodi attigui sede precoce di eventuali cellule metastatiche. Dopo la resezione del segmento di colon interessato, la continuità intestinale viene ripristinata mediante la sutura dei segmenti di colon residuo (anastomosi). In caso di resezioni del retto questa sutura può essere a rischio di tenuta e pertanto viene creato un ano artificiale (stomia) di protezione sulla parete addominale per un tempo definito che viene rimosso con un successivo intervento chirurgico.
In caso di tumore troppo vicino all’ano che l’asportazione comporterebbe l’impossibilità di ripristinare continuità intestinale è necessario eseguire un intervento più demolitivo chiamato Amputazione Addominoperineale (o Miles) che prevede l’asportazione di tutto il retto ed il canale anale con il tessuto perineale circostante, e la creazione di un ano artificiale definitivo sulla parete addominale.
Come può essere eseguito l’intervento chirurgico
Può essere eseguito con la tecnica tradizionale che prevede l’apertura dell’addome mediante un taglio verticale mediano.
Può essere eseguito con una tecnica mininvasiva sia laparoscopica che robotica che prevede 5/6 piccole incisioni da circa 1 cm attraverso cui con una telecamera e degli strumenti dedicati si entra all’interno dell’addome e viene condotto lo stesso tipo di intervento che verrebbe condotto con la tecnica tradizionale riducendo però al minimo il trauma al paziente.
Quali sono I vantaggi della chirurgia robotica per questo tipo di intervento
La chirurgia robotica offre particolari vantaggi soprattutto nel trattamento chirurgico del tumore del retto, soprattutto perché grazie alla sua definizione ed all’accuratezza permette di procedere all’asportazione del tratto intestinale arrecando il minimo trauma a strutture nervose situate in quella sede importanti soprattutto per la funzione sessuale.
Permette di eseguire resezioni del retto molte basse arrivando a pochi cm dal margine anale senza compromettere la continenza sfinterica.
>Riduce al minimo la manipolazione della lesione riducendo la possibilità di diffusione di cellule maligne.
>Riduce in modo significativo le perdite di sangue non la conseguente riduzione della necessità di eseguire emo-trasfusioni.
>Offre la possibilità in alcuni casi di operare anche tumori di dimensioni maggiori ed in pazienti obesi che difficilmente potrebbero essere operati in laparoscopia e che quindi necessiterebbero di una conversion in intervento tradizionale. Ci sono evidenze che i tassi di conversion degli interventi in chirurgia robotica sono sensibilmente inferiori a quelli in chirurgia laparoscopica.
>Riduce al minimo la manipolazione dei visceri favorendo una più rapida ripresa della loro motilità nel post-operatorio
>Offre la possibilità al paziente, laddove necessario, di iniziare prima il trattamento di Chemioterapia post-operatoria.
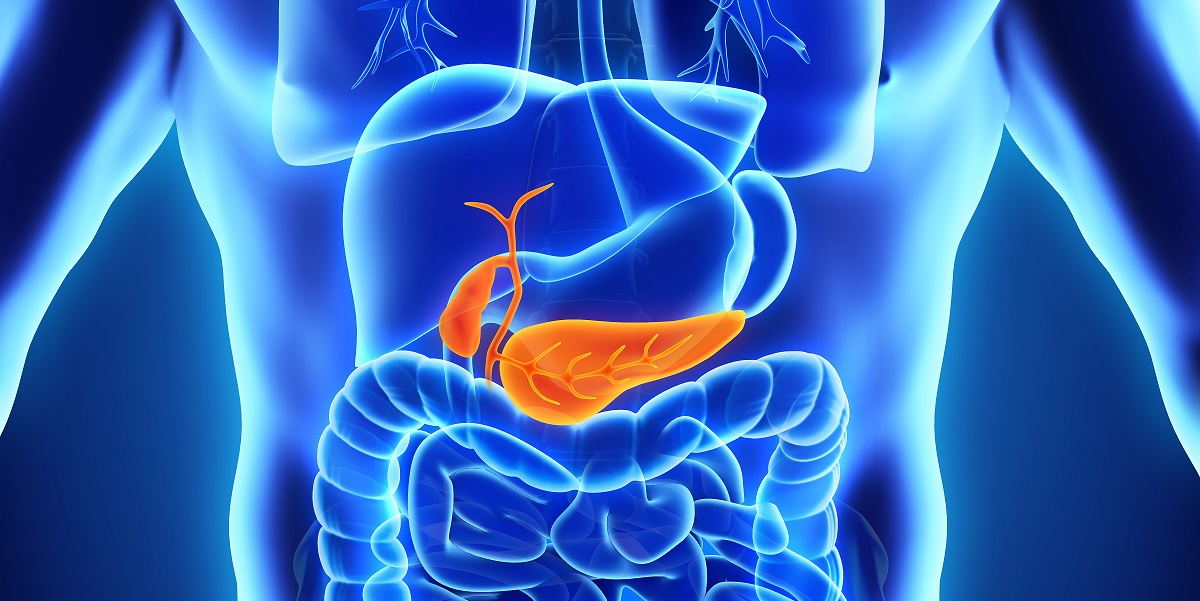
Tumore del Pancreas
Che cos’è?
Il pancreas è un organo che può essere diviso in tre parti: la testa, il corpo e la coda. La sua funzione è quella di produrre ormoni tra cui l’insulina ed enzimi che trasportati da specifici dotti sono necessari alla digestione intestinale. Le cellule che producono ormoni sono chiamate endocrine, mentre quelle che producono enzimi sono chiamate esocrine. Quando alcune di queste cellule iniziano a moltiplicarsi con una crescita anomala e incontrollata siamo di fronte ad una malattia neoplastica che quindi può essere di origine endocrina o esocrina. La regione più frequentemente colpita da queste lesioni è la testa (circa 70%) e nella maggior parte dei casi hanno origine dai dotti che trasportano gli enzimi all’intestino.
Evoluzione
Purtroppo il tumore del pancreas è uno dei tumori che più facilmente si diffonde ai linfonodi vicini e ad altri organi ed inoltre è una delle neoplasie più “subdole” da un punto di vista clinico, in quanto non si manifesta finchè non ha raggiunto dimensioni tali da interessare strutture anatomiche vicine come vasi, duodeno o coledoco che danno una chiara manifestazione clinica. Tutto ciò, fa del tumore al pancreas una delle neoplasie più difficili da curare.
Sintomi
Come detto la presentazione clinica del tumore del pancreas è piuttosto vaga e molto spesso i sintomi iniziali possono essere trascurati sia dal paziente sia dai medici con il rischio che la diagnosi venga fatta quando la malattia è ormai già estesa.
Sintomi più chiari si evidenziano quando la neoplasia ha raggiunto dimensioni tali da interessare gli organi contigui o ha infiltrato i dotti biliari.
I sintomi più comuni in questi casi sono: iterro (colorazione giallastra della pelle) con prurito, nausea, vomito, stanchezza, dolore all’addome ed alla schiena. A volte, in una piccola percentuale di casi, può insorgere anche il diabete.
Come si fa la diagnosi
L’esame di prima scelta per la diagnosi del tumore del pancreas è la TC, ma in alcuni casi, alcune lesioni possono essere diagnosticate anche mediante ecografia dell’addome classica e in altri selezionati mediante ecografia endoscopica attraverso il duodeno.
In caso di ittero da ostruzione della via biliare è possibile fare una Colangiopancreatografia retrograda endoscopica (ERCP), una colangiografia transepatica percutanea o una colangiorisonanza magnetica. Questi esami servono a vedere se il tumore causa un’ostruzione della via biliare; I primi due sono invasivi ma permettono anche di fare delle biopsie o dei trattamenti palliativi o propedeuci all’intervento chirurgico come posizionamenti di drenaggi o stent.
Come si cura
La terapia di prima scelta, quando è possibile e la malattia non ha avuto ancora una diffusione agli organi circostanti, è l’intervento chirurgico che è diverso a seconda della sede di localizzazione del tumore.
La chemioterapia in alcuni casi può essere necessaria dopo l’intervento chirurgico, mentre insieme alla radioterapia rappresenta il trattamento di prima scelta nei casi di tumore avanzato che non può essere asportato chirurgicamente.
In che cosa consiste l’intervento chirurgico
Per i tumori della testa del pancreas è indicate la Duodenocefalopancreasectomia che prevede l’asportazione in blocco del duodeno con o senza parte dello stomaco, della testa del pancreas e del dotto biliare principale, ed una successiva ricostruzione del tratto digerente, della via biliare e del pancreas residuo con l’intestino.
Per i tumori del corpo è indicata una mesopancreasectomia che prevede l’asportazione della parte centrale del pancreas e successive ricostruzione del pancreas residuo con l’intestino.
Per I tumori della coda è indicata una splenopancreasectomia in questo caso viene asportato in blocco la coda del pancreas e la milza senza intaccare il tubo digerente. In alcuni casi può essere indicato eseguire una pancreasectomia totale.
Si tratta di interventi chirurgici molto complessi che possono avere un alto tasso di complicanze con una percentuale di mortalità che in alcuni casi raggiunge il 10% soprattutto in pazienti che arrivano all’intervento in condizioni generali scadenti per l’avanzato stadio di malattia.
Come può essere eseguito l’intervento chirurgico
Può essere eseguito con la tecnica tradizionale che prevede l’apertura dell’addome mediante un taglio verticale mediano o un taglio trasversale sottocostale.
Può essere eseguito con una tecnica mininvasiva sia laparoscopica che robotica che prevede 5/6 piccole incisioni da circa 1 cm attraverso cui con una telecamera e degli strumenti dedicati si entra all’interno dell’addome e viene condotto lo stesso tipo di intervento che verrebbe condotto con la tecnica tradizionale riducendo però al minimo il trauma al paziente.
Quali sono I vantaggi della chirurgia robotica per questo tipo di intervento
La chirurgia robotica grazie alle sue caratteristiche, durante l’intervento di resezione pancreatica permette una notevole accuratezza nell’asportazione dei linfonodi.
In caso di Duodenocefalopancreasectomia permette una particolare accuratezza nella fase ricostruttiva, soprattutto per la ricostruzione dei dotti biliari e pancreatici che possono avere un diametro molto piccolo di solo alcuni millimetri.
>Riduce in modo significativo le perdite di sangue non la conseguente riduzione della necessità di eseguire emo-trasfusioni.
>Riduce le complicanze peri o post-operatorie soprattutto spesso legate alla ricostruzione dei dotti biliary e pancreatici.
>Offre la possibilità in alcuni casi di operare anche tumori di dimensioni più grandi che non potrebbero essere operati in laparoscopia ma che necessiterebbero di un intervento tradizionale.
>Riduce al minimo la manipolazione dei visceri favorendo una più rapida ripresa della loro motilità nel post-operatorio
>Offre la possibilità al paziente, laddove necessario, di iniziare prima il trattamento di Chemioterapia post-operatoria.
>Offre la possibilità, grazie all’esecuzione di un’ecografia intraoperatoria mediante una sonda studiata appositamente per l’utilizzo con il robot, di individuare e quindi asportare lesioni di soli alcuni mm di dimensioni per esempio in caso di tumori di origine endocrina come l’insulinoma.
Chirurgia mininvasiva
Il sistema robotico da Vinci è stato introdotto nella pratica clinica all’inizio degli anni 2000. La prima indicazione al suo impiego fu il bypass coronarico a cuore battente. Da allora la chirurgia robotica ha avuto un progressivo sviluppo tecnico, con un crescente numero di indicazioni in molte discipline chirurgiche.
L’ausilio della tecnologia robotica ha modificato l’approccio alla chirurgia mini-invasiva, talvolta anche in modo radicale e determinante. In alcuni casi è stato possibile eseguire interventi tecnicamente molto complessi e non effettuabili con le metodiche mini-invasive convenzionali. Per altre procedure è decisamente migliorata la qualità tecnica rispetto all’approccio mini-invasivo standard.
In linea generale possiamo identificare tre categorie di interventi chirurgici:
Interventi non modificati dalla tecnica robotica
Nel primo gruppo rientrano gli interventi a limitata complessità tecnica, per i quali la tecnica laparoscopica è già ampiamente standardizzata e consente di ottenere risultati tecnici soddisfacenti. Queste procedure non sono significativamente modificate dall’impiego del robot.
Ad esempio in Chirurgia Generale i vantaggi apportati dalla tecnologia robotica negli interventi di colecistectomia, di plastica del giunto gastro-esofageo e di resezione del colon sinistro sono assai modesti (anche se restano pur sempre superiori alla laparoscopia convenzionale la visione tridimensionale, la stabilità del campo operatorio e la manipolazione endocorporea).
Interventi migliorati dalla tecnica robotica
In questo gruppo rientra gran parte degli interventi di cui è stata dimostrata la fattibilità in chirurgia mini-invasiva convenzionale, ma per i quali la complessità tecnica ne limita l’esecuzione e la diffusione.
La chirurgia resettiva esofagea e gastrica, la chirurgia maggiore dei parenchimi (pancreas, fegato polmone, rene, milza),
Interventi fattibili esclusivamente con tecnica robotica
In questo gruppo sono incluse le procedure per le quali non esiste esperienza in chirurgia mini-invasiva convenzionale (o comunque viene riportata in modo sporadico) a causa dell’altissima complessità tecnica e delicatezza delle strutture anatomiche interessate.
Rientrano in questo gruppo le aneurismectomie viscerali con ricostruzione dei vasi interessati e le pancreasectomie con resezione vascolare. In questi casi, oltre ad un’accurata dissezione delle strutture vascolari, la tecnica robotica consente la ricostruzione delle stesse mediante anastomosi di altissima precisione.
Altro esempio è rappresentato dalla tiroidectomia totale trans-ascellare: soltanto il robot può consentire di lavorare con precisione in uno spazio così ristretto e volumetricamente inadeguato per le tecniche mini-invasive convenzionali.
Principi generali alle indicazioni
E’ dato per scontato che, indipendentemente dalle considerazioni tecniche, le indicazioni chirurgiche robotiche sulle singole patologie tengono conto in ogni caso delle attuali evidenze scientifiche, alle quali sono vincolati i comportamenti clinici sia in chirurgia aperta, sia laparoscopica (specialmente in campo oncologico).
APPLICAZIONI IN CHIRURGIA GENERALE
Le attuali applicazioni in Chirurgia Generale sono molteplici, spaziando dalla chirurgia digestiva superiore, a quella colo-rettale, epatobiliopancreatica ed endocrina.
L’intervento è sicuro?
Ogni intervento chirurgico ha i suoi rischi, a volte possono verificarsi situazioni tali che complicano un intervento che non presenterebbe nessuna difficoltà da un punto di vista teorico. Ma sicuramente vengono adoperate tutte le misure perché ciò non avvenga e soprattutto tutte le misure atte a non arrecare danni al paziente nel caso in cui questi eventi dovessero verificarsi.
Ma poi torno come prima?
Un intervento chirurgico, in generale tende a violare l’integrità fisica di una persona, ma il fine è di eliminare un qualcosa che arreca danno al benessere fisiologico. Anche se lasciando dei segni fisici, l’intervento chirurgico consente di ripristinare il più delle volte l’integrità fisica del paziente.
E’ doloroso?
Un adeguata terapia analgesica, concertata con gli anestesisti fanno si di ridurre al minimo il dolore. Ovviamente interventi eseguiti con tecniche mininvasive sono molto meno dolorosi di interventi eseguiti con tecnica tradizionale, questo consente di ridurre al minimo l’uso di farmaci analgesici con meccanismo di azione a livello del sistema nervoso centrale come ad esempio gli oppiodi.
Dopo quanti giorni dall’intervento devo andare al bagno?
Non c’è una regola fissa, molto dipende dal tipo di intervento subito. In linea di massima soprattutto in interventi eseguiti con tecnica mininvasiva il paziente, si canalizza prima ai gas e poi alle feci nel giro di 1-3 giorni, molto più precocemente rispetto ad interventi con tecnica tradizionale. Questo è dovuto alla minore manipolazione dell’intestino e alla più rapida ripresa della mobilità dei pazienti operati con tecnica mininvasiva.
Una volta dimesso dall’ospedale, dopo quanti giorni di mancata evacuazione devo iniziare a preoccuparmi?
Si deve preoccupare se scompare completamente la canalizzazione anche ai gas per più di 24 h, associato a dolore addominale, addome disteso e nausea o vomito. In questi casi contatterà me o i medici della equipe e valuteremo il suo problema.
Dovrò assumere una dieta particolare dopo l’intervento? Dopo quanto potrò ricominciare a mangiare?
Tutti i nostri pazienti nel post-operatorio seguono dei protocolli ERAS (“Enhanced Recovery After Surgery”, ovvero miglior recupero dopo un intervento chirurgico); in pratica ricominciano ad alimentarsi molto precocemente, spesso possono bere la sera dell’intervento e mangiare una dieta morbida in prima giornata post-operatoria. Il tipo di alimentazione da poter assumere dipende anche dall’intervento subito, in caso per esempio di resezioni gastriche il paziente più che modificare il tipo di dieta dovrà modificare il modo in cui mangiare, facendo pasti frequenti ma di ridotte quantità. In ogni caso tutti i pazienti vengono presi in carico da un team di dietiste che seguiranno il paziente anche dopo la dimissione.
Chi mi seguirà adesso?
Una volta eseguito l’intervento sarà seguito durante il ricovero da me e dalla equipe medica di cui faccio parte, al momento della dimissione, se necessario, sarà inserito in un percorso finalizzato alla sua completa guarigione. In questo percorso troverà, oltre al sottoscritto, diversi professionisti di varie branche cliniche che si occuperanno di lei. Ovviamente potrà sempre far riferimento a me per qualsiasi necessità o problema dovesse sopraggiungere.